新闻动态
氨基保护基种类繁多,酰基是其中一类常用的保护基,包括磺酰基、邻苯二甲酰基和单酰基等,前文已对磺酰基和邻苯二甲酰基系列进行了相关介绍,本文将简要概述单酰基系列的氨基保护基,主要包括乙酰基(Ac)、苯甲酰基(Bz)和三氟乙酰基(Tfa)。
单酰基是一类种类繁多的氨基保护基群体,在多肽和药物合成中应用广泛。其中,乙酰基、苯甲酰基和三氟乙酰基较为常用(图1),尤其是三氟乙酰基,因其便捷的脱除方法非常契合正交保护策略,在多肽合成中备受欢迎。
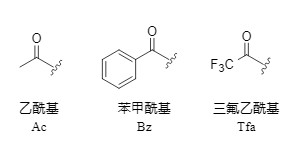
图1 常见的单酰基保护基
乙酰基和苯甲酰基等缺乏强吸电子基团,通常需要剧烈的水解条件才能脱除,容易造成多肽的消旋化和其他保护基的脱除,因此其应用范围受到一定的限制。
鉴于三氟乙酰基的强吸电子性,其性质与苯甲酰基和乙酰基差异显著。因此,本文将苯甲酰基和乙酰基归为非卤代酰基统一说明。
常规法
常规的酰基引入方法通常采用酸酐/酰氯在碱存在下进行酰化引入酰基,亦或者是在缩合试剂的促进下,通过羧酸与胺的偶联反应引入酰基,以乙酰基为例(图2),乙酰氯和乙酸酐的引入方法如下:
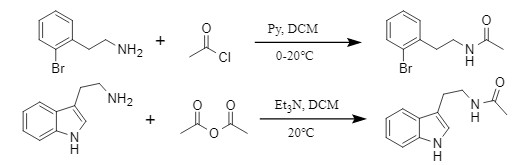
图2 乙酰基引入方法
特殊法
①酰胺法
Pathare等人开发了一种改性钨酸盐(Sulfated tungstate)催化的转酰胺化反应,通过改性钨酸盐的催化,将酰胺与胺类化合物反应转化成新的酰胺化合物(图3),此法适用于多种芳酰胺和脂肪族酰胺,反应条件温和,效率高。
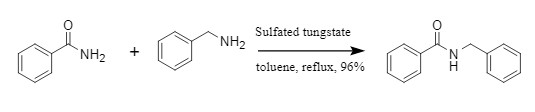
图3 改性钨酸盐催化的转酰胺化反应
②N-酰基苯并三氮唑法
Agha等人开发了一种新型的酰基引入方法,将酰基苯并三氮唑作为酰化试剂,可以在水、正丁醇等绿色溶剂中,选择性对未保护的芳香/脂肪族二胺进行单酰基化,同时还可以对脂肪二胺进行逐步酰化,合成不对称的二酰胺(图4)。
图4 不对称二酰胺的合成
酰胺键的稳定性比较高,在温和条件下脱酰基较为困难,相较于酯基的水解而言,酰胺的水解往往需要更加剧烈的条件才能实现。
常规法
通常情况下,在强酸性/碱性条件下高温反应才能脱去酰基,以苯甲酰基为例(图5),分别在酸性和碱性条件下脱酰:
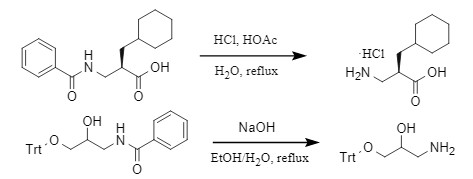
图5 苯甲酰基的脱除方法
特殊法
①溴化铵法
Shimizu等人开发了一种微波辅助下,溴化铵和乙二胺协同作用的脱酰化方法,收率高,可兼容多种官能团(图6)。
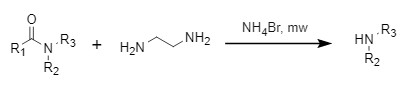
图6 溴化铵与乙二胺协同脱酰
②氨水法
曾教授团队开发了一种温和的脱酰方法,采用氨水作为脱酰试剂,反应条件温和,收率高,适用于多种取代的吲哚等系列化合物(图7)。
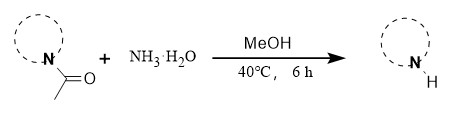
图7 氨水脱酰化反应
卤代乙酰基在卤素原子的影响下,更加容易脱除。其中,代表性保护基三氟乙酰基可在温和的碱性条件下脱除,并广泛应用于多肽和药物合成中。
三氟乙酸酐(TFAA)
三氟乙酸酐活性高,通常需要在较低的温度和碱存在下进行(图8),是一种常见的三氟乙酰化试剂,但其在引入Tfa时,容易造成手性中心的消旋化亦或者肽键断裂等副反应。
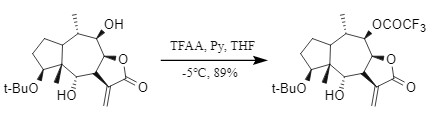
图8 三氟乙酸酐引入Tfa
三氟乙酸(TFA)
相较于三氟乙酸酐和三氟乙酰氯,三氟乙酸的沸点较高,应用场景更广。其可以在微波促进下对取代苯胺进行三氟乙酰化(图9)。也可通过经典羧酸-胺缩合反应引入,亦或者在二甲苯中加热直接对芳胺进行三氟乙酰化。
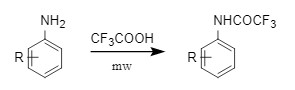
图9 三氟乙酸引入Tfa
三氟乙酸乙酯
三氟乙酸乙酯常应用于多肽合成中,在0℃、THF中与胺反应即可实现。在空间位阻效应的影响下,该试剂可以在仲胺存在下,选择性的保护伯胺(图10)。即使同为伯胺,不同烷基也会有反应效果的差异,如叔丁胺和异丁胺同时存在下,会优先与位阻小的异丁胺反应(比例占98%)。
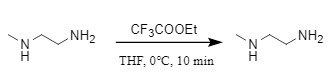
图10 三氟乙酸乙酯引入Tfa
酰氧基鏻盐
通过三氟乙酸钠/三苯基膦/碘、三氟乙酸/三苯基膦/NBS制备碘/溴化酰氧基鏻盐,继而被胺攻击得到三氟乙酰胺(图11)。
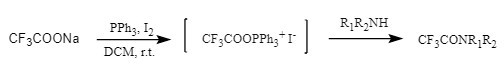
图11 酰氧基鏻盐引入Tfa
其他试剂
许多引入试剂为三氟乙酸/三氟乙酸酐的衍生物,通过合成带有易离去基团的衍生物,如酰基咪唑、酰基苯并三氮唑等,与胺反应得到相应的酰胺。
三氟乙酰基的脱除方法比较温和,在强酸性条件下比较稳定,可与Boc、Z、Trt、Alloc等保护基团兼容,常见有以下几种脱除方法:
Na2CO3(K2CO3)/MeOH/H2O(图12)
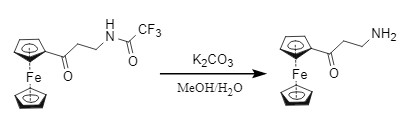
图12 碳酸盐脱Tfa
水合肼/甲醇
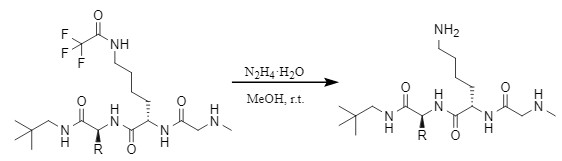
图13 水合肼脱Tfa
其他方法
除了上述脱酰方法,还有如下几种温和的脱除方法,包括NaOH水溶液,1 M哌啶水溶液、NaBH4/EtOH等方法。
参考文献:
[1] 郭艳浩,蒿庆辉,郝思媛等. 化工产品中氨基的保护与脱保护[J]. 煤炭与化工, 2022, 45, 106-112.
[2] 高旭红,李炳奇. 有机合成中的氨基保护及应用(综述)[J]. 石河子大学学报(自然科学版), 1999, 3, 76-86.
[3] Balieu, S.; Toutah, K.; Rousselière, H.; et al. Radical cyclization of ynamides into six- or eight-membered rings. Application to the synthesis of a protoberberine analog[J]. Tetrahedron Lett., 2011, 52, 2876-2880.
[4] Warren, H. T.; Saeger, H. N.; Rasmussen, K.; et al. Psychoplastogenic DYRK1A Inhibitors with Therapeutic Effects Relevant to Alzheimer’s Disease[J]. J. Med. Chem., 2024, 67, 6922−6937.
[5] Pathare, A. P.; Jain, A. K. H.; Akamanchi, K. G. Sulfated tungstate: a highly efficient catalyst for transamidation of carboxamides with amines[J]. RSC Adv., 2013, 3, 7697-7703.
[6] Agha, K. A.; Abo-Dya, N. D., Abdel-Samii, Z. K.; et al. N-Acylbenzotriazole: convenient approach for protecting group-free monoacylation of symmetric diamines[J]. Monatsh. Chem., 2020, 151, 589–598.
[7] Doboszewski, B., Groaz, E., Herdewijn, P. Synthesis of Phosphonoglycine Backbone Units for the Development of Phosphono Peptide Nucleic Acids[J]. Eur. J. Org. Chem., 2013, 4804–4815.
[8] Benkel, T.; Annala, S.; Gütschow, M.; et al. BIM-46174 Fragments as Potential Ligands of G Proteins[J]. Med. Chem. Commun., 2019, 00, 1-3.
[9] Shimizu, Y.; Morimoto, H.; Zhang, M.; Ohshina, T. Microwave-Assisted Deacylation of Unactivated Amides Using Ammonium-Salt-Accelerated Transamidation[J]. Angew. Chem. Int. Ed. 2012, 51, 8564–8567.
[10] 韩群,徐坤,曾程初等. 一种利用酰胺基转移反应脱除酰基保护基的实用方法[J]. 有机化学, 2022, 42, 1123-1128.
[11] López, S. E.; Restrepo, J.; Salazar, J. Trifluoroacetylation in Organic Synthesis: Reagents, Developments and Applications in the Construction of Trifluoromethylated Compounds[J]. Curr. Org. Synth., 2010, 7, 414-432.
[12] Piotrowicz, M.; Maslowska, N.; Rudolf, B.; et al. Synthesis of Trifluoroacetamidoketones by Acylation of Ferrocene with In Situ Protected Amino Acids[J]. J. Org. Chem., 2025, 90, 2958−2968.
[13] Heller, P.; Weber, B.; Birke, A.; Barz, M. Synthesis and Sequential Deprotection of Triblock Copolypept(o)ides Using Orthogonal Protective Group Chemistry[J]. Macromol. Rapid Commun., 2015, 36, 38−44.
[14] Isidro-Llobet, A.; Álvarez, M.; Albericio, F. Amino Acid-Protecting Groups[J]. Chem. Rev., 2009, 109, 2455–2504.

