新闻动态
氨基是常见的活性基团,在反应中往往需要事先保护。其保护基种类繁多,此前已介绍了酰基系列的保护基,本文开始将介绍烷基类保护基。
三苯甲基系列保护基是一类空间位阻较大的保护基,引入和脱除条件温和,操作简便,其稳定性高,特别适用于多官能团化合物的选择性保护。此外,三苯甲基系列保护基的引入有助于化合物形成晶体,易通过结晶法提纯。
常见的三苯甲基系列保护基主要包括:三苯甲基(Trt),4-甲氧基三苯甲基(MMT),4,4'-双甲氧基三苯甲基(DMT),4,4',4''-三甲氧基三苯甲基(TMT)(图1),该系列保护基在碱性条件或亲核试剂存在下比较稳定,但在酸性条件下易被脱除,其在酸性条件下的脱除活性为TMT>DMT>MMT>Trt。鉴于该系列保护基的引入和脱除方法基本相似,本文着重以Trt为例进行介绍。
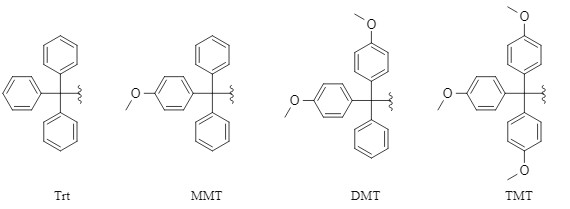
图1 常见的三苯甲基系列保护基结构
由于位阻较大,三苯甲基系列保护基通常用于保护伯胺,其功能与三氟乙酸乙酯、N-乙氧羰基邻苯二甲酰亚胺类似,可实现伯胺的选择性保护。此外,在多肽合成中,三苯甲基保护能有效抑制反应过程中的消旋化,尤其适用于含组氨酸的多肽。
Trt保护基通常在碱性条件下采用Trt-Cl进行反应,这是最常用的引入方法之一,其他方法还包括Trt-OH(三苯甲醇)和Ac2O在酸性条件下进行,或采用TMSCl/Et3N/Trt-Cl的组合引入三苯甲基,实例如图2:
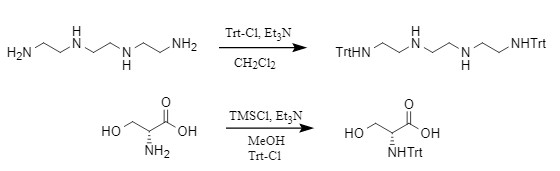
图2 三苯甲基引入实例
尽管三苯甲基的稳定性比较高,却是酸敏感基团,在多种酸性条件下很容易脱除,如盐酸体系、TFA、醋酸等。Boc保护基通常也是在酸性条件下脱除,故可依据不同保护基对酸敏感的差异进行选择性脱除,例如:在50%HOAc水溶液中,可以很容易脱除Trt,而Boc保护基不受影响。Sieber等人考察了Trt-His(Trt)-Lys(Boc)-OMe中Trt、Boc保护基的稳定性(图3),发现组氨酸侧链的Trt保护基要比α-氨基上的Trt更稳定,而且,在1 N HCl/醋酸体系内,Boc会被脱去而组氨酸侧链的Trt不受影响。

图3 Trt-His(Trt)-Lys(Boc)-OMe中Trt、Boc保护基的稳定性探究
除此之外,三苯甲基还可以通过以下方法脱保护:
1. 还原脱除
可在Pd/C氢化(下图)、Na/NH3(l)等还原条件下脱去Trt保护基。其中,在催化氢化条件下,Trt的脱除速度显著低于O-Bn、N-Cbz等保护基,故可以根据不同保护基的特性进行选择性脱除。
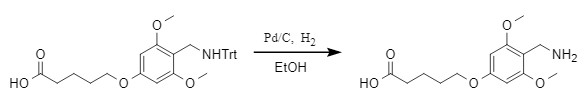
图4 Pd/C催化氢化脱Trt
另外,Chandrasekhar团队开发了一种将N-Trt保护一步转化为N-Boc保护的方法,通过Pd(OH)2/C、PMHS(聚甲基氢硅氧烷)的作用下,实现单步合成N-Boc化合物,效率高,底物范围广。
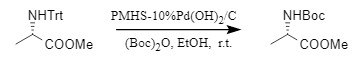
图5 一步法合成N-Boc保护
2. 路易斯酸脱除
对于对质子酸敏感的底物,路易斯酸如ZnBr2,BF3·Et2O等是有效的脱保护试剂。例如,在BF3·Et2O/Me3SiH/HFIP(六氟异丙醇)体系内可以快速,高效脱除。
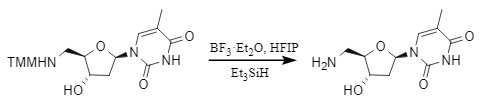
图6 路易斯酸脱MMT
3.CAN(硝酸铈铵)试剂脱除
CAN试剂可以通过单电子转移的方式脱除Trt,从而氨基转变为氨基负离子,过程中需要醋酸等提供氢质子才能得到游离胺,否则会重新生成原料。
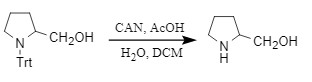
图7 CAN试剂脱Trt
三苯甲基系列保护基以其易于引入和脱除的特性,广泛应用于核苷和多肽合成中。空间位阻为其提供较好选择性的同时,也对某些反应产生了限制:大部分的Trt-氨基酸难以采用混酐法、叠氮法构建酰胺键,同时Trt-氨基酸酯由于较大的空间位阻,其酯基水解也较为困难。
因此,科研工作者在深入了解各类保护基特性后,可结合具体反应条件和分子结构特点,选择最合适的保护策略,以高效合成目标化合物。
参考文献:
[1] 张盼盼,郑土才,陈盛等. 三苯甲基类保护基在有机合成中的应用进展[J]. 合成化学研究, 2014, 2, 28-40.
[2] Ito, C.; Taguchi, K.; Matsumoto, K.; et al. Trimethoxy Trityl Groups as a Potent Substituent for Anti-cancer Cytidine Analog Prodrugs[J]. J. Pharm. Sci., 2022, 111, 2201-2209.
[3] Sieber, P.; Riniker, B. Protection of carboxamide functions by the trityl residue. Application to peptide synthesis[J]. Tetrahedron Lett., 1991, 32, 739-742.
[4] Krakowiak, K. E.; Bradshaw, J. S. Selective Protection of the Primary Amine Functions of Linear Tetraamines Using the Trityl Group[J]. Synth. Commun., 1998, 28, 3451-3459.
[5] Baghery, S.; Zarei, M.; Behranvand, V.; et al. Application of trityl moieties in chemical processes: part I[J]. J. Iran. Chem. Soc., 2020, 17, 2737-2843.
[6] Sieber, P.; Riniker, B. Protection of histidine in peptide synthesis: A Reassessment of the trityl group[J]. Tetrahedron Lett., 1987, 28, 6031-6034.
[7] Sharma, S. K.; Songster, M. F.; Castellino, F. J.; et al. Reductive Amination with Tritylamine as an Ammonia Equivalent: Efficient Preparation of the 5-[4-[(9-Fluorenylmethyloxycarbonyl)- amino]methyl]-3,5-dimethoxyphenoxy]valeric Acid (PAL) Handle for Peptide Synthesis[J]. J. Org. Chem., 1993, 58, 4993-4996.
[8] Chandrasekhar, S.; Babu, B. N.; Reddy, C. R. Single-step conversion of N-benzyl, N-trityl and N-diphenylmethyl amines to t-butyl carbamates using polymethylhydrosiloxane[J]. Tetrahedron Lett., 2003, 44, 2057-2059.
[9] Bege, M.; Bereczki, L.; Herczegh, P.; et al. A three-component reagent system for rapid and mild removal of O-, N- and S-trityl protecting groups[J]. Org. Biomol. Chem., 2016, 1–3.
[10] Pattanayak, S.; Sinha, S. Ceric ammonium nitrate-mediated detritylation of tritylated amines[J]. Tetrahedron Lett., 2011, 55, 34-37.

