新闻动态
消旋化是指手性分子在化学反应中发生立体异构体转变的过程,这一现象在多肽合成中尤为重要。氨基酸消旋化是多肽合成过程中的主要副反应,其异构化产物具有高度相似的物理特性,从而增加分离纯化难度,这不仅影响分子的整体构型,最终影响甚至改变多肽的生物活性和功能。因此,在多肽合成过程中保持氨基酸的手性至关重要。
1. 碱催化的烯醇化反应:
羧酸活化形成的活性中间体在强碱性环境下或者α位连接强吸电子基团时,α-H易被夺取重排形成烯醇中间体。而在重新质子化的过程中是无选择性的,因此最终会形成外消旋氨基酸酯,这种消旋途径在碳二亚胺类缩合试剂介导的缩合反应中可能会形成(图1,Path A)。
2. 烯酮过渡态:
活化羧酸在碱性环境下发生消除反应,活性基团离去形成烯酮过渡态,胺进攻烯酮中间体不具备立体选择性,因此得到消旋化的多肽产物,此途径可能会出现在酰氯存在的缩合反应中(图1, Path B)。
3. 噁唑酮过渡态:
相较上述两种消旋机制,第三种消旋化产生机制则更加常见,常发生于N-酰基保护的α-氨基酸参与的缩合反应中。羧酸经活化后,在碱性环境下,酰胺键中N-H被去质子化,使得活化中间体发生分子内环化形成噁唑酮中间体,经由共轭阴离子的过渡态导致分子发生消旋,从而胺与其发生反应时,得到消旋化的多肽产物(图1, Path C)。
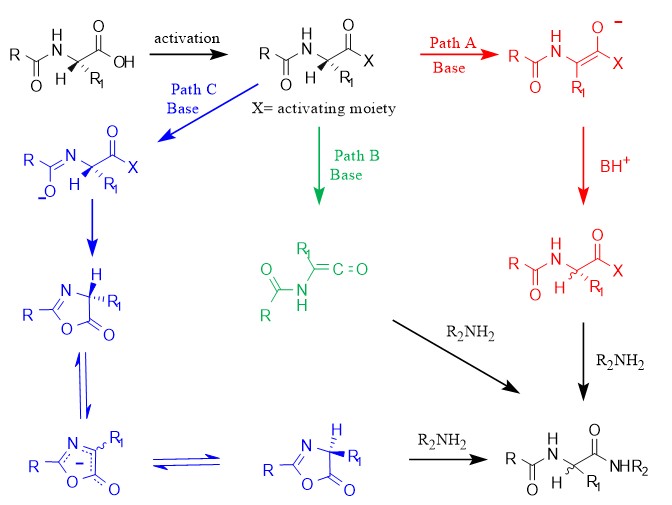
图1 三种消旋化途径
基于上述消旋机制分析,α-H和酰胺键的N-H是引发消旋化的关键结构要素,通过分子设计调控这些活性位点的反应性,则会很大限度的降低消旋化问题。
在多肽合成中,消旋化程度受多重因素调控,主要包括缩合试剂类型、氨基酸结构特性、碱、反应溶剂和温度等相关参数。
1. 缩合试剂:
不同的缩合试剂形成的活性中间体反应活性不尽相同,这也导致了其发生消旋化的可能性存在差异,如碳二亚胺类缩合试剂(DCC、DIC等)相较于脲正离子型(HATU、HBTU等)更容易发生消旋化。
2. 氨基酸结构特性:
不同氨基酸具有不同的化学性质和空间构型,某些氨基酸在特定的条件下更倾向于发生消旋化。除了从上述反应机制中获取的α-H和酰胺的活泼氢会对消旋化产生影响外,诸如底物的空间位阻效应:(1)α-C连接的R基团位阻越大,越容易发生消旋化;(2)丙氨酸和缬氨酸在同样环境下发生缩合反应时,缬氨酸更容易发生消旋化,约为丙氨酸的两倍。
3. 碱的影响:
缩合反应中发生消旋化的程度与碱息息相关,很多缩合剂介导的缩合反应通常需要碱的参与。研究表明,碱的空间位阻以及碱的用量均会影响消旋化程度:在同等当量下,DIPEA做碱时比TEA产生的消旋化程度更小;同为DIPEA时,所用当量越高发生消旋化的比例越大(在能促进反应的前提下所进行的测试)。
4.反应环境参数:
溶剂:反应中的消旋化过程通常历经的中间体是带电荷的,反应溶剂的溶剂化效应可能会起到稳定异构化中间体的作用。
温度:高温下会对消旋化产生一定的影响。
1. 缩合试剂优化:
前文提到了缩合试剂对消旋化的影响很大,选用合适的缩合试剂或添加剂对降低消旋化程度具有很大的帮助。针对传统碳二亚胺试剂易引发消旋化的问题,可通过引入HOBt、HOAt或Oxyma等消旋抑制试剂,有效降低消旋化问题。除此之外,采用新型的缩合试剂如赵试剂Ynamide(MYMsA、MYTsA),Oxyma系列缩合试剂(COMU等)(图2)可以降低甚至避免消旋化的发生。
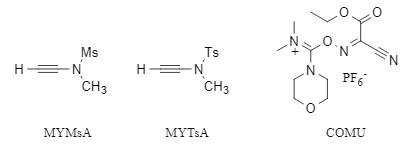
图2 新型缩合试剂
2.保护基团:
氨基甲酸酯类保护基可以降低噁唑酮的形成风险,另外,有些氨基酸的侧链会影响到目标反应的进行,如组氨酸侧链的咪唑环易诱导组氨酸的消旋化,选用合适的保护基如PMBOM、NAPOM能有效避免消旋化的发生(图3)。
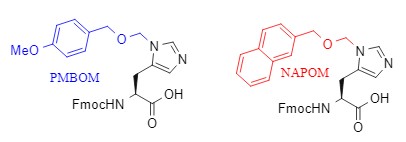
图3 组氨酸侧链保护基
3.反应条件:
碱:选用大位阻,碱性较弱的碱可以有效降低消旋化程度。
反应溶剂:小极性非质子溶剂可以降低消旋化问题。
反应温度:较低的温度通常有助于保持氨基酸的立体选择性。
4. 其他合成技术:
机械合成方法:采用球磨辅助在无溶剂或者很少溶剂的条件下进行反应,从而降低溶剂化效应,实现很高的反应收率和极小的消旋化问题。
自动化快速流动多肽合成技术(AFPS):相较于传统的固相合成方法,反应速度更快。流速增加及反应时间的缩短可以有效降低消旋化产物
微波辅助合成策略:可以加快反应速率,提高反应收率,降低消旋化程度。
参考文献:
[1] Duengo, S.; Muhajir, M. I.; Maharani, R.; et al. Epimerisation in Peptide Synthesis[J]. Molecules, 2023, 28, 8017.
[2] Guo, Y. Y.; Wang, M. Y.; Gao, Y.; Liu, G. D. Recent advances in asymmetric synthesis of chiral amides and peptides: racemization-free coupling reagents[J]. Org. Biomol. Chem., 2024, 22, 4420-4435.
[3] Magano, Javier. Large-Scale Amidations in Process Chemistry: Practical Considerations for Reagent Selection and Reaction Execution[J]. Org. Process Res. Dev. 2022, 26, 1562-1689.
[4] El-Faham, A.; Albericio, F. Peptide Coupling Reagents, More than a Letter Soup[J]. Chem. Rev., 2011, 111, 6557-6602.
[5] Montalbetti, C. A. G. N.; Falque, V. Amide bond formation and peptide coupling[J]. Tetrahedron, 2005, 61, 10827-10852.
[6] Carpino, L. A.; Ionescu, D.; El-Faham, A. Peptide Coupling in the Presence of Highly Hindered Tertiary Amines[J]. J. Org. Chem., 1996, 61, 2460-2465.

